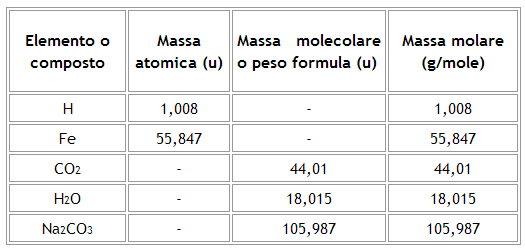
La massa molare è definita come il rapporto tra la massa e la quantità di sostanza di un composto.
La sua unità di misura nel sistema internazionale è il chilogrammo su mole ma viene spesso utilizzato, per comodità, il grammo su mole .
Relazione tra la massa molare e la massa molecolare
La massa molecolare, m, (impropriamente chiamata peso molecolare) è la massa di una singola molecola, e viene misurata in unità di massa atomica (u) o in Dalton (Da).
La massa molare, M, invece è la massa di una mole di molecole e viene quindi misurata in g/mol. È la grandezza più corretta da utilizzare quando si parla di quantità macroscopiche.
Le due grandezze sono legate dalla costante di Avogadro, NA.
Prima della ridefinizione delle unità di misura del SI del 2019 la massa molecolare e la massa molare avevano lo stesso valore numerico. A seguito della ridefinizione delle unità la costante di Avogadro ha assunto un valore esatto; di conseguenza il prodotto tra la costante di massa atomica e la costante di Avogadro non è più esattamente pari a 1 g/mol ma ha un valore leggermente maggiore. Il prodotto di queste due costanti è noto come costante di massa molare e il suo valore è pari a: , questa differenza non ha però rilevanza per gli usi pratici.
Massa molare degli elementi
La massa molare (M) di un elemento chimico è data dal prodotto tra la sua massa atomica relativa (Ar) e la costante di massa molare (Mu ≈ 1×10-3 kg/mol), .
Ad esempio per il ferro:
Massa molare dei composti
La massa molare di un composto chimico è data dalla somma delle masse molari dei singoli elementi che lo compongono; ossia dal prodotto tra la somma delle masse atomiche relative e la costante di massa molare:
dove Mr è la massa molecolare relativa.
Ad esempio per il metano, ():
Massa molare delle miscele
La massa molare di una miscela è calcolabile utilizzando la seguente formula:
dove xi è la frazione molare del componente i e Mi la sua massa molare.
Se sono note le frazioni massiche (ponderali) dei componenti, wi, la massa molare della miscela può essere ricavata da:
Le due formulazioni sono equivalenti e portano chiaramente allo stesso risultato.
Note
Bibliografia
- (EN) IUPAC, Quantities, Units and Symbols in Physical Chemistry, 3ª ed., RSC Publisching, 2007, ISBN 9780854044337.
Voci correlate
- Costante di massa molare
- Massa molecolare
- Massa atomica
- Quantità di sostanza
- Unità di massa atomica
Altri progetti
- Wikizionario contiene il lemma di dizionario «massa molare»

![Molare Masse berechnen • Formel & Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/10/WP_Molare-Masse_pse-1-1024x576.jpg)